"Demorou alguns anos, mas, em 1878, o francês Lecoq de Boisbaudran afinal obteve um belo e puro pedaço de gálio. Apesar de sua forma sólida numa temperatura ambiente moderada, o gálio derrete a 29°C, o que significa que, se você segurá-lo na palma da mão o material se derrete numa pequena poça granulosa e espessa quase como mercúrio. O gálio é um dos poucos metais líquidos que se pode tocar sem queimar os dedos até o osso. Por essa razão, desde então o gálio se tornou fonte de piadas entre os conhecedores da química, já que ele é facilmente moldável e parece alumínio, é fazer colheres de gálio, servir numa xícara de chá e observar quando o convidado se assusta ao ver o chá "comer" o utensílio." (A Colher que Desaparece - San Kean)
"Não se pode ensinar tudo a alguém, pode-se apenas ajudá-lo a encontrar por si mesmo." Galileu Galilei
segunda-feira, 26 de dezembro de 2011
De volta!
E nesse clima de final de ano o "Ciência no Cotidiano" está de volta, gente!
A faculdade deu uma folga e agora posso dar atenção ao blog de novo....
Mas é isso ai...
Boas festas e vamo que vamo pra 2012. Muito sucesso, paz, amor e, claro, ciência pra todos nós.
A faculdade deu uma folga e agora posso dar atenção ao blog de novo....
Mas é isso ai...
Boas festas e vamo que vamo pra 2012. Muito sucesso, paz, amor e, claro, ciência pra todos nós.
sábado, 23 de abril de 2011
segunda-feira, 11 de abril de 2011
A Química do Chocolate
"Ciencia no Cotidiano" em clima de Páscoa!
 Sua ligação com a paixão e com o bem estar existe, pois ao ingerir chocolate, uma série de substâncias que esse alimento contém, como a feniletilamina e o triptofano são introduzidas no organismo. Além disso, há liberação de endorfina, que é um opióide produzido pelo próprio organismo.
Sua ligação com a paixão e com o bem estar existe, pois ao ingerir chocolate, uma série de substâncias que esse alimento contém, como a feniletilamina e o triptofano são introduzidas no organismo. Além disso, há liberação de endorfina, que é um opióide produzido pelo próprio organismo.
Uma das substâncias em questão, o triptofano, é um precursor da serotonina. A serotonina pode estar ligada ao aumento de apetite e à obesidade. Isso foi comprovado em animais de laboratório onde aumentaram o apetite, e em alguns casos observou-se o desenvolvimento da obesidade. Além disso, há estudos que compravam a ligação da serotonina com o humor. Isso se dá, pois há uma ampla distribuição desse neurotransmissor no sistema límbico. Experimentos já foram realizados, onde o triptofano foi usado no tratamento de depressão com o objetivo de aumentar a síntese de 5-HT.
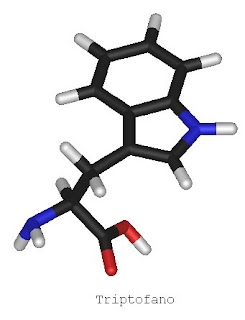 Além dos efeitos que a serotonina pode desencadear, a ingestão de chocolate aumenta os níveis de endorfina no cérebro. A endorfina é relacionada ao bom humor, sensação de bem-estar e euforia e também a um efeito analgésico. Com todos esses efeitos, os ditos chocólatras podem tentar justificar o seu vicío. Porém os poucos estudos nessa área, revelam que ainda não há um consenso se o chocolate pode realmente viciar, pois é evidente que há uma alteração química no corpo, mas não necessariamente essa alteração pode causar algum tipo de dependência.
Além dos efeitos que a serotonina pode desencadear, a ingestão de chocolate aumenta os níveis de endorfina no cérebro. A endorfina é relacionada ao bom humor, sensação de bem-estar e euforia e também a um efeito analgésico. Com todos esses efeitos, os ditos chocólatras podem tentar justificar o seu vicío. Porém os poucos estudos nessa área, revelam que ainda não há um consenso se o chocolate pode realmente viciar, pois é evidente que há uma alteração química no corpo, mas não necessariamente essa alteração pode causar algum tipo de dependência.
Mas, como eu sempre digo para meu namorado....chocolate me faz tãoooo feliz!
E agora tá explicado o porquê...
Fonte: http://neuromed88.blogspot.com
Associado à paixão, ao bem estar e, para alguns exagerados, ao vício, o chocolate é um alimento extremamente antigo, sendo que já foi idolatrado por certos povos, como os astecas.
 Sua ligação com a paixão e com o bem estar existe, pois ao ingerir chocolate, uma série de substâncias que esse alimento contém, como a feniletilamina e o triptofano são introduzidas no organismo. Além disso, há liberação de endorfina, que é um opióide produzido pelo próprio organismo.
Sua ligação com a paixão e com o bem estar existe, pois ao ingerir chocolate, uma série de substâncias que esse alimento contém, como a feniletilamina e o triptofano são introduzidas no organismo. Além disso, há liberação de endorfina, que é um opióide produzido pelo próprio organismo.Uma das substâncias em questão, o triptofano, é um precursor da serotonina. A serotonina pode estar ligada ao aumento de apetite e à obesidade. Isso foi comprovado em animais de laboratório onde aumentaram o apetite, e em alguns casos observou-se o desenvolvimento da obesidade. Além disso, há estudos que compravam a ligação da serotonina com o humor. Isso se dá, pois há uma ampla distribuição desse neurotransmissor no sistema límbico. Experimentos já foram realizados, onde o triptofano foi usado no tratamento de depressão com o objetivo de aumentar a síntese de 5-HT.
 Além dos efeitos que a serotonina pode desencadear, a ingestão de chocolate aumenta os níveis de endorfina no cérebro. A endorfina é relacionada ao bom humor, sensação de bem-estar e euforia e também a um efeito analgésico. Com todos esses efeitos, os ditos chocólatras podem tentar justificar o seu vicío. Porém os poucos estudos nessa área, revelam que ainda não há um consenso se o chocolate pode realmente viciar, pois é evidente que há uma alteração química no corpo, mas não necessariamente essa alteração pode causar algum tipo de dependência.
Além dos efeitos que a serotonina pode desencadear, a ingestão de chocolate aumenta os níveis de endorfina no cérebro. A endorfina é relacionada ao bom humor, sensação de bem-estar e euforia e também a um efeito analgésico. Com todos esses efeitos, os ditos chocólatras podem tentar justificar o seu vicío. Porém os poucos estudos nessa área, revelam que ainda não há um consenso se o chocolate pode realmente viciar, pois é evidente que há uma alteração química no corpo, mas não necessariamente essa alteração pode causar algum tipo de dependência.Mas, como eu sempre digo para meu namorado....chocolate me faz tãoooo feliz!
E agora tá explicado o porquê...
Fonte: http://neuromed88.blogspot.com
segunda-feira, 4 de abril de 2011
A Química durante a Segunda Guerra Mundial
O mais interessante na química, que podemos observar através da história, são os extremos que estão presentes em grande parte dos estudos e das descobertas realizadas. Como os benefícios da energia nuclear em contraste com os males causados pela radiação, ou os avanços tecnológicos na área da medicina lado a lado ao uso de substâncias tóxicas em prisioneiros condenados à pena de morte.
Impossível pensar na história da química e não lembrar-se logo das bombas atômicas. Porém, a química tanto mudou o rumo de guerras como teve sua história alterada também pela existência destas. Se fizéssemos um gráfico que representasse o desenvolvimento da ciência durante a história, provavelmente, veríamos os pontos máximos deste gráfico ocorrendo durante os períodos em que o mundo esteve em guerra. A capacidade que a química demonstrou de mudar drasticamente a situação em campos de batalha, durante a Primeira Grande Guerra, com o uso pioneiro de gases tóxicos nas trincheiras, fez com que cientistas fossem estimulados e principalmente financiados a pesquisar e descobrir novas formas de que seu país se mostrasse superior ao país adversário. A mesma química que estuda a criação do universo, o desenvolvimento de novos medicamentos também é aquela que desenvolve bombas nucleares.
A química começou a ser usada em campos de batalha na Primeira Guerra Mundial com os gases tóxicos lançados contra a trincheira inimiga; gases como os lacrimogêneos, o gás de mostarda e o gás cloro. Muitos gases usados durante essa guerra foram desenvolvidos pelo químico Fritz Haber, ganhador do Prêmio Nobel de 1918 pela síntese da Amônia (NH3). Mais um exemplo de que podemos ter os dois lados da moeda na ciência.
Mas, apesar de após a primeira guerra, os países terem assinado um acordo impedindo o uso de gases tóxicos para fins bélicos, quando a segunda guerra mundial estourou ninguém mais se lembrou desse tratado. Os famosos campos de concentração de Hitler, como Auschwitz, começaram a utilizar câmaras de gás para a execução de grande quantidade de pessoas de uma única vez. O gás mais usado é ainda conhecido como Zyklon B, porém esse gás era na verdade o Ácido Cianídrico
Outra influência da área cientifica na segunda guerra, inclusive acredito que seja esta a que primeiro vem a mente da maioria das pessoas: a Bomba Atômica
Esse ano comemoramos o centenário do primeiro Prêmio Nobel dado a uma mulher, Marie Curie, responsável por voltar os olhos de muitos cientistas para a radiação. Mas isso não explica a criação da bomba, certo? O que ocorreu na época da segunda guerra e que culminou no holocausto foi na década de 30 com Lise Meitner e Otto Hahn, descobridores da “Fissão Nuclear”. Eles bombardearam o núcleo do urânio com nêutrons, na expectativa de produzir algum elemento novo que fosse mais pesado do que o urânio original. Porém percebeu-se que após o bombeamento conseguia-se o elemento Bário, muito mais leve que o Urânio. Lise que tivera que fugir da Alemanha por ser judia recebeu as informações de Otto e deduziu que o núcleo do Urânio estava se quebrando, denominando Fissão Nuclear. Otto Hahn recebeu o Premio Nobel por essa descoberta, mas Hitler impediu-o de receber. Esse processo de quebra do núcleo liberava uma quantidade imensa de energia e Otto Hahn juntamente com Heisenberg passaram a pesquisar a possibilidade de que esse processo fosse feito em cadeia, obviamente, para a produção da famosa bomba.
Heisenberg, um dos maiores nome da física era aluno de ninguém menos que Niels Bohr, sim, aquele da teoria atômica, e assim Bohr ficou sabendo da probabilidade de que Alemanha dispusesse em pouco tempo de uma bomba atômica colocando em risco toda a humanidade. Bohr e seu amigo Albert Einstein, influente nos EUA, escreveram, então, uma carta ao presidente Roosevelt, alertando-o da ameaça. O presidente por sua vez criou o Plano Manhattan, destinado a pesquisas sobre fissão nuclear e fabricação de armamento nuclear. E é nesta parte da historia que vemos Enrico Fermi e Oppenheimer, cientista famoso por construir a primeira bomba nuclear.
Em 1945, o resultado dos estudos de Meitner e Hahn, dos temores de Bohr e Einstein e da obsessão de Oppenheimer caiu sobre as cidades de Hiroshima e Nagasaki... colocando fim a um dos períodos mais sombrios e mais revolucionários da História.
Ana Pedrozo |
| Esquema de como funciona a Fissão Nuclear descoberta por Meitner e Hahn. |
 |
| Dizem que HCN tem cheiro de amêndoas... Alguém ai quer confirmar? |
sexta-feira, 1 de abril de 2011
Tabela Periódica - XENÔNIO
O Xenônio foi obtido em 1898 por Willian Ramsay eMorris Travers, como um dos componentes do ar atmosférico. Isso foi realizado a partir da destilação fracionada do ar atmosférico líquido.
Xenônio deriva do grego "Xenon", que significa estranho.
Ele é utilizado em tubos luminosos, produzindo cor azul esverdeada. Além de ser utilizado em equipamentos que produzem luz estroboscópica, em lâmpadas bactericidas e para bronzeamento.
O gás pode ser armazenado com segurança em recipientes convencionais de vidro selados a temperatura e pressão ambiente. O xenônio não é tóxico, porém vários de seus compostos são altamente tóxicos devido as suas fortes propriedades de oxidação.
Xenônio deriva do grego "Xenon", que significa estranho.
Ele é utilizado em tubos luminosos, produzindo cor azul esverdeada. Além de ser utilizado em equipamentos que produzem luz estroboscópica, em lâmpadas bactericidas e para bronzeamento.
O gás pode ser armazenado com segurança em recipientes convencionais de vidro selados a temperatura e pressão ambiente. O xenônio não é tóxico, porém vários de seus compostos são altamente tóxicos devido as suas fortes propriedades de oxidação.
terça-feira, 22 de março de 2011
2011 - Ano Internacional da Química
No ano do centenário do primeiro Prêmio Nobel a uma mulher: Marie Curie; 2011 foi definido como o Ano Internacional da Quimica; com direito a site, livros, artigos virtuais, simposios pelo mundo afora e tudo com muita, mas muita química!
No site Coleção Ano Internacional da Química, a SBQ está disponibilizando o material comemorativo. Além dos números da revista Química Nova na Escola e seus Cadernos Temáticos, temos lá a coletânea de experimentos A Química Perto de Você e mais 7 e-books da Coleção Química no Cotidiano Os e-books são sobre os seguintes temas: A Química do Amor, Química e Energia, Química e o Controle de Dopagem no Esporte, A Química dos Alimentos, A Química no Cuidado da Pele, Química na Saúde e Química na Natureza.
Seguindo a mesma linha do Calendário do Ano Internacional da Química, a Sociedade Brasileira de Química lançou 365 Dias de Química, um site no qual a cada dia de 2011 será possível acessar informações acerca de um assunto sobre a Química no cotidiano e o cotidiano da Química
Acessem : Química Nova Interativa e além de artigos sobre vários temas da química, a cada dia você conhece uma molécula nova, suas características e seus usos!
domingo, 20 de março de 2011
Tema: Tabela Periódica
Você sabia quê? Os nomes dos elementos químicos têm diversas origens. Dez deles são muito antigos, 8 levam o nome de corpos celestes, 10 referem-se a seres mitológicos, 13 têm nomes de minerais, 9 têm a ver com a cor, 10 mencionam o lugar geográfico onde foram encontrados, 14 referem-se ao País em que as descobertas foram feitas, 16 levam nomes construídos de acordo com certas características do elemento e 11 levam nomes de pessoas.
E a partir de hoje terá o post com o tema "Tabela Periódica" onde vou falar de cada elemento, um por vez ...
Acompanhe :)
sexta-feira, 11 de março de 2011
Um pouquinho da Química Forense - Luminol
Já assistiu CSI? Ou leu algum romance policial? Dexter?
Se você respondeu sim para alguma dessas perguntas, com certeza, já se perguntou como funciona o tal do luminol né?
A reação que ocorre entre o luminol e o sangue é a chamada quimiluminescência. Ou seja, reação que libera energia em forma de luz *-* olha que bonito.
O processo é mais ou menos assim:
O luminol é um pó - formado por átomos de carbono, hidrogênio, oxigênio e nitrogênio - que é diluído em água oxigenada. O luminol reage em meio alcalino com o percarbonato, o ferro da hemoglobina catalisa essa reação e libera uma luz azulada, suficientemente forte para ser vista no escuro.
"É produzida quimicamente uma excitação em um elemento químico. No caso do luminol em contato com o ferro, esse elemento é o oxigênio", diz o biologista forense Mark Benecke, da International Forensic Research & Consulting, uma entidade de pesquisa criminalística da Alemanha. Abaixo, a gente explica os detalhes dessa reação.
2. Após fazer uma varredura completa no local, o perito borrifa a solução de luminol com água oxigenada nos pontos onde ele acha que pode haver vestígios de sangue. Esse procedimento é o último a ser feito pela perícia pois o luminol pode destruir outras evidências
3. Quando as gotas da solução de luminol entram em contato com o ferro da hemoglobina do sangue, átomos de nitrogênio (N) e hidrogênio (H) escapam das moléculas do luminol. De outro lado, a solução passa a capturar átomos de oxigênio (O) do sangue
4. Os elétrons dos átomos de oxigênio se agitam pela saída do nitrogênio e do hidrogênio. A energia dessa movimentação dos elétrons é dissipada em forma de partículas luminosas. O resultado é uma luz azulada que identifica o local onde estão vestígios de sangue.
Curiosidade Química: A água sanitária (NaClO) também "ativa" o luminol, mas a cor fica diferente!
Se você respondeu sim para alguma dessas perguntas, com certeza, já se perguntou como funciona o tal do luminol né?
A reação que ocorre entre o luminol e o sangue é a chamada quimiluminescência. Ou seja, reação que libera energia em forma de luz *-* olha que bonito.
O processo é mais ou menos assim:
O luminol é um pó - formado por átomos de carbono, hidrogênio, oxigênio e nitrogênio - que é diluído em água oxigenada. O luminol reage em meio alcalino com o percarbonato, o ferro da hemoglobina catalisa essa reação e libera uma luz azulada, suficientemente forte para ser vista no escuro.
"É produzida quimicamente uma excitação em um elemento químico. No caso do luminol em contato com o ferro, esse elemento é o oxigênio", diz o biologista forense Mark Benecke, da International Forensic Research & Consulting, uma entidade de pesquisa criminalística da Alemanha. Abaixo, a gente explica os detalhes dessa reação.
Hora de dar à luz
Reação química revela pistas ocultas na cena de um crime
1. Um perito da polícia chega até a casa de um suspeito. A olho nu, ele não vê sinais de sangue - o assassino limpou o carpete da casa onde matou a vítima. Porém, mesmo após a faxina, no meio das fibras do carpete, ficam escondidas moléculas de sangue2. Após fazer uma varredura completa no local, o perito borrifa a solução de luminol com água oxigenada nos pontos onde ele acha que pode haver vestígios de sangue. Esse procedimento é o último a ser feito pela perícia pois o luminol pode destruir outras evidências
3. Quando as gotas da solução de luminol entram em contato com o ferro da hemoglobina do sangue, átomos de nitrogênio (N) e hidrogênio (H) escapam das moléculas do luminol. De outro lado, a solução passa a capturar átomos de oxigênio (O) do sangue
4. Os elétrons dos átomos de oxigênio se agitam pela saída do nitrogênio e do hidrogênio. A energia dessa movimentação dos elétrons é dissipada em forma de partículas luminosas. O resultado é uma luz azulada que identifica o local onde estão vestígios de sangue.
Curiosidade Química: A água sanitária (NaClO) também "ativa" o luminol, mas a cor fica diferente!
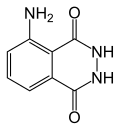
A fórmula química do luminol está descrita abaixo:

Seu nome IUPAC é 5-Amino-2,3-dihidro-1,4-ftalazinadiona
Fonte: Diário de um Químico Digital
Fonte: Diário de um Químico Digital
terça-feira, 8 de março de 2011
Elementos: Mistérios Desvendados
Ouro todo mundo conhece. É aquele metal amarelo, brilhante, comumente encontrado no TEMÍVEL formato de aliança.
O mercúrio também é fácil de reconhecer. Encontrado dentro de termômetros, tem cor cinza e é líquido à temperatura ambiente.
Prata, ferro, alumínio, carbono… Todos estes elementos são fáceis de encontrar por aí e grande parte das pessoas os reconhecem.
Mas vai dizer que você nunca pensou, ao olhar o elemento 115 na tabela periódica, “meu, como será que é este ununpentium”? Eu sempre pensei isso. Unumpentium é um nome fabuloso para um material.
-De que é feito o amortecedor deste teu tênis?
-Unumpentium.
-OMG! Eu preciso comprar meu novo Nike hoje mesmo!
Se você é assim como eu, então seus problemas se acabaram. A Universidade de Nottingham, terra do xerife mais famoso da antiga Inglaterra, lançou o site The Periodic Table of Videos, onde vídeos dos elementos da tabela periódica podem ser encontrados.
Neste vídeos, pesquisadores da universidade manipulam amostras dos elementos, de modo que podemos finalmente ver como é a cara daquele monte de siglas desconhecidas.
Tudo em inglês, obviamente.
Aliás o cara tem uma canequinha shooow de bola, da qual eu terei uma cópia em questão de dias.
E talvez venda algumas na faculdade $.$
Se não quiser o link joga no youtube o nome do elemento que você deseja ver (em inglês) e veja como ele é...como ele reage...no que é usado.. etc.
Pena que não é desta vez que vocês conhecerão o unumpentium. De acordo com o vídeo, ele só existe em teoria: uma amostra real dele nunca foi observada.
Vale a pena um terço do meu salário ir em aulas de inglês.
Obrigada e volte sempre.
Atualização
Fonte: A Grande Abóbora
O mercúrio também é fácil de reconhecer. Encontrado dentro de termômetros, tem cor cinza e é líquido à temperatura ambiente.
Prata, ferro, alumínio, carbono… Todos estes elementos são fáceis de encontrar por aí e grande parte das pessoas os reconhecem.
Mas vai dizer que você nunca pensou, ao olhar o elemento 115 na tabela periódica, “meu, como será que é este ununpentium”? Eu sempre pensei isso. Unumpentium é um nome fabuloso para um material.
-De que é feito o amortecedor deste teu tênis?
-Unumpentium.
-OMG! Eu preciso comprar meu novo Nike hoje mesmo!
Se você é assim como eu, então seus problemas se acabaram. A Universidade de Nottingham, terra do xerife mais famoso da antiga Inglaterra, lançou o site The Periodic Table of Videos, onde vídeos dos elementos da tabela periódica podem ser encontrados.
Neste vídeos, pesquisadores da universidade manipulam amostras dos elementos, de modo que podemos finalmente ver como é a cara daquele monte de siglas desconhecidas.
Tudo em inglês, obviamente.
Aliás o cara tem uma canequinha shooow de bola, da qual eu terei uma cópia em questão de dias.
Se não quiser o link joga no youtube o nome do elemento que você deseja ver (em inglês) e veja como ele é...como ele reage...no que é usado.. etc.
 |
| Magnésio, I love you. |
Vale a pena um terço do meu salário ir em aulas de inglês.
Obrigada e volte sempre.
Atualização
Fonte: A Grande Abóbora
domingo, 20 de fevereiro de 2011
Fogos de Artifício (2)
Esse vídeo mostra a queima do magnésio metálico e a emissão de uma luz branca intensa. Adiantem para 1:00 para verem a experiência.
Fogos de Artifício
Acho que uma das coisas que mais gera interesse dos jovens pela química são as reações coloridas ... Sabe aquela aula de complexos inorgânicos que cada tubo de ensaio fica de uma cor? Pois é... todo mundo prestando atenção e depois tirando foto dos tubos coloridos. Fato.
Por isso, resolvi mostrar aqui a principal utilização dessa emissão de cores dos elementos químicos.
Este fenômeno é usado, por exemplo, na produção dos fogos de artifício. Este é basicamente, um dispositivo que fica envolvido em um cartucho de papel (em geral, em forma de cilindro). Na parte inferior do cartucho fica a carga explosiva que dispara os fogos para o alto, o propelente mais utilizado é a pólvora negra, esta nada mais é do que uma mistura de salitre (nitrato de potássio), enxofre e carvão, que foi um grande e importante desenvolvimento na história da humanidade. Outro propelente comum é o altamente explosivo perclorato de potássio (KClO4), que é misturado com a pólvora. Na parte superior fica a 'bomba', com pequenos pacotinhos de sais de diferentes elementos. Quando os fabricantes desejam produzir fogos de artifício coloridos, misturam à pólvora compostos de certos elementos químicos apropriados, utilizam sais de diferentes metais na mistura explosiva (pólvora) para que, quando detonados, produzam cores diferentes.
O perclorato de potássio é, em geral, mais seguro de usar que o clorato. O problema é a dificuldade de obtenção do sal no comércio. Na América do Norte, o único fabricante de percloratos prepara o perclorato de amônio, o oxidante dos foguetes propulsores do ônibus espacial.
O aspecto mais notável dos fogos de artifício são as cores e os clarões. A luz branca é produzida pela oxidação do magnésio ou do alumínio a alta temperatura e, os clarões ofuscantes nos concertos de bandas de rock são de misturas de Mg e KClO4.
A luz amarela é a mais fácil de se obter, pois os sais de sódio (Na) na forma de clorita, NaAlF6 emitem-na intensamente. Para conseguir o vermelho-carmim, colocam estrôncio (Sr). Quando querem o azul-esverdeado, utilizam cobre (Cu). Desejando o verde, empregam o bário (Ba), se a cor desejada for a violeta, usam o potássio (K) e para o vermelho podem utilizar o cálcio (Ca). Na hora em que a pólvora explode, a energia produzida excita os elétrons desses átomos, ou seja, os elétrons "saltam" de níveis de menor energia (mais próximos do núcleo) para níveis de maior energia (mais distantes). Quando retornam aos níveis de menor energia, liberam a energia que absorveram, na forma de luz colorida.
Por isso, resolvi mostrar aqui a principal utilização dessa emissão de cores dos elementos químicos.
As cores produzidas em um show de fogos de artifício são produzidas a partir de dois fenômenos, a incandescência e a luminescência.
A incandescência é a luz produzida pelo aquecimento de substâncias. Quando se aquece um metal, por exemplo, ele passa a emitir radiação infravermelha, que vai se modificando até se tornar radiação visível na cor branca. Isso irá depender de qual temperatura é atingida. Um exemplo de incandescência são as lâmpadas incandescentes, onde existe um filamento de tungstênio que é aquecido e passa a produzir luz, a partir da incandescência. Este fenômeno é, também, visto nos fogos de artifício, nos quais são utilizados metais como o alumínio e magnésio, que ao queimarem produzem alta claridade.
A luminescência é a luz produzida a partir emissão de energia, na forma de luz, por um elétron excitado, que volta para o nível de energia menos energético de um átomo.
Este fenômeno, a luminescência, pode ser explicado da seguinte forma:
1) Um átomo, de um elemento químico qualquer, possui elétrons em níveis de energia. Ao receber energia, estes elétrons são excitados, ou seja, são promovidos a níveis de energia mais elevados. A quantidade de energia absorvida por um elétron é quantizada, ou melhor, é sempre em quantidades precisas, não podendo ser acumulada.
2) O elétron excitado tem a tendência de voltar para o nível menos energético, pois é mais estável. Quando ocorre esta passagem, do nível mais energético para o menos, ocorre também a liberação da energia absorvida, só que agora, na forma de um fóton, ou seja, na forma de luz.
A luminescência é uma característica de cada elemento químico. Ou seja, átomos de sódio quando aquecido, emitem luz amarela, pela luminescência. Já os átomos de estrôncio e lítio produzem luz vermelha. Os de bário produzem luz verde e assim por diante.Este fenômeno é usado, por exemplo, na produção dos fogos de artifício. Este é basicamente, um dispositivo que fica envolvido em um cartucho de papel (em geral, em forma de cilindro). Na parte inferior do cartucho fica a carga explosiva que dispara os fogos para o alto, o propelente mais utilizado é a pólvora negra, esta nada mais é do que uma mistura de salitre (nitrato de potássio), enxofre e carvão, que foi um grande e importante desenvolvimento na história da humanidade. Outro propelente comum é o altamente explosivo perclorato de potássio (KClO4), que é misturado com a pólvora. Na parte superior fica a 'bomba', com pequenos pacotinhos de sais de diferentes elementos. Quando os fabricantes desejam produzir fogos de artifício coloridos, misturam à pólvora compostos de certos elementos químicos apropriados, utilizam sais de diferentes metais na mistura explosiva (pólvora) para que, quando detonados, produzam cores diferentes.
O perclorato de potássio é, em geral, mais seguro de usar que o clorato. O problema é a dificuldade de obtenção do sal no comércio. Na América do Norte, o único fabricante de percloratos prepara o perclorato de amônio, o oxidante dos foguetes propulsores do ônibus espacial.
O aspecto mais notável dos fogos de artifício são as cores e os clarões. A luz branca é produzida pela oxidação do magnésio ou do alumínio a alta temperatura e, os clarões ofuscantes nos concertos de bandas de rock são de misturas de Mg e KClO4.
A luz amarela é a mais fácil de se obter, pois os sais de sódio (Na) na forma de clorita, NaAlF6 emitem-na intensamente. Para conseguir o vermelho-carmim, colocam estrôncio (Sr). Quando querem o azul-esverdeado, utilizam cobre (Cu). Desejando o verde, empregam o bário (Ba), se a cor desejada for a violeta, usam o potássio (K) e para o vermelho podem utilizar o cálcio (Ca). Na hora em que a pólvora explode, a energia produzida excita os elétrons desses átomos, ou seja, os elétrons "saltam" de níveis de menor energia (mais próximos do núcleo) para níveis de maior energia (mais distantes). Quando retornam aos níveis de menor energia, liberam a energia que absorveram, na forma de luz colorida.
domingo, 13 de fevereiro de 2011
Por que a cebola faz chorar?
Corte uma cebola em pedaços para fazer o refogado e em poucos segundos as lágrimas rolam bochechas abaixo. Mas se a receita mandar apenas tirá-la de sua embalagem natural e jogá-la inteira no cozido, não há o menor problema. Não precisa ser Sherlock Holmes para deduzir onde está a causa de toda a choradeira: no corte da cebola.
Também é o corte, diga-se de passagem, que perfuma o refogado. Cortar, amassar ou triturar alhos e cebolas resulta na destruição de milhões de células, que liberam seu conteúdo: é aquele caldinho que suja a faca. Nele estão, entre outras coisas, um sulfóxido do aminoácido cisteína e enzimas chamadas alinases, que provocam a transformação do sulfóxido em ácido propenilsulfênico. Aquele perfume maravilhoso do refogado vem a seguir, com a transformação espontânea do ácido propenilsulfênico em tiossulfinato: este é o mocinho cheiroso da estória.O vilão ardido é outro. O tiossulfinato cheiroso não é o único resultado da reação desencadeada pela destruição das células. O ácido propenilsulfênico, dizia-se, também se transforma espontaneamente em propanotial-S-óxido -- este sim o fator lacrimogêneo volátil que irrita os olhos e dispara o reflexo de produção de lágrimas em abundância. São tantas que o duto lacrimal, que despeja para dentro do nariz as lágrimas constantes que limpam e lubrificam os olhos, não dá mais conta. Resultado: transbordamento de lágrimas. O que é a melhor coisa que poderia acontecer aos seus olhos, já que você insistiu em expô-los a uma substância irritante…
Aqui você já deve estar se perguntando: se tanto alhos como cebolas, parentes próximos em espécie e cheiro, têm sulfóxido de cisteína que é transformado pela alinase em ácido propenilsulfênico que vira espontaneamente tanto o cheiroso tiossulfinato quanto o ardido fator lacrimogêneo propanotial-S-óxido, por que diabos espremer alho não faz chorar? Ah… A resposta tradicional era que "por alguma razão, no alho cortado o ácido propenilsulfênico se transforma espontaneamente só no cheiroso tiossulfinato".
Ô desculpa fajuta!
Um grupo de japoneses acaba de publicar, na revista Nature de 17 de outubro, uma resposta muito melhor. A primeira parte da resposta é que o tal do ácido propenilsulfênico NÃO se transforma espontaneamente no fator lacrimogêneo coisíssima nenhuma.
A segunda parte é que quem faz isso é uma outra enzima, até então desconhecida, que apenas as cebolas possuem, e que os pesquisadores tiveram a original e conveniente idéia de nomear -- adivinhem! -- sintase do fator lacrimogêneo.
Ou seja: o ácido propenilsulfênico formado quando se destroem as células de alhos e cebolas se transforma espontaneamente, sim, no tiossulfinato que dá o perfume ao refogado. Mas os olhos só ardem com as cebolas porque só elas possuem a tal da segunda enzima que converte o mesmo ácido em fator lacrimogêneo.
O bacana é que isso quer dizer que dá, em princípio, para acabar com a produção do vilão fator lacrimogêneo sem mexer no tiossulfinato -- que é realmente o mocinho da estória: além de perfumado, é ele o responsável por todas as outras boas razões para se comer cebolas. O tiossulfinato é antiinflamatório, antialergênico, antiasmático, antidiabético, anti-hipertensivo...
E para acabar com a choradeira na cozinha, os pesquisadores sugerem nada menos que a criação de uma cebola transgênica sem a sintase do fator lacrimogêneo, que seria tão perfumada quanto as outras porque a alinase e a produção de tiossulfinato permaneceriam intocadas. Simples, não é?
Enquanto outros pesquisadores têm coisas mais importantes a fazer do que colocar cebolas-sem-sintase-do-fator-lacrimogêneo nos supermercados, a gente continua com os velhos truques para cortar cebolas sem chorar. Um truque (comprovado pelo Cérebro Nosso!) é colocar as cebolas na geladeira antes de cortar, já que o frio inibe a atividade das enzimas. Outros são cortar cebolas embaixo d'água (o que não é nada prático) ou na frente de um ventilador que sopre os vapores para longe de você; colocar óculos de mergulho e tapar o nariz com um pregador de roupa (senão o fator lacrimogêneo chega aos olhos pelo lado de dentro!); usar uma faca extremamente afiada, para diminuir a destruição das células… e tem até quem defenda um palito de fósforo preso nos lábios, ou um pedaço de pão na boca.
(Fonte: A Graça da Química)
Também é o corte, diga-se de passagem, que perfuma o refogado. Cortar, amassar ou triturar alhos e cebolas resulta na destruição de milhões de células, que liberam seu conteúdo: é aquele caldinho que suja a faca. Nele estão, entre outras coisas, um sulfóxido do aminoácido cisteína e enzimas chamadas alinases, que provocam a transformação do sulfóxido em ácido propenilsulfênico. Aquele perfume maravilhoso do refogado vem a seguir, com a transformação espontânea do ácido propenilsulfênico em tiossulfinato: este é o mocinho cheiroso da estória.O vilão ardido é outro. O tiossulfinato cheiroso não é o único resultado da reação desencadeada pela destruição das células. O ácido propenilsulfênico, dizia-se, também se transforma espontaneamente em propanotial-S-óxido -- este sim o fator lacrimogêneo volátil que irrita os olhos e dispara o reflexo de produção de lágrimas em abundância. São tantas que o duto lacrimal, que despeja para dentro do nariz as lágrimas constantes que limpam e lubrificam os olhos, não dá mais conta. Resultado: transbordamento de lágrimas. O que é a melhor coisa que poderia acontecer aos seus olhos, já que você insistiu em expô-los a uma substância irritante…
Aqui você já deve estar se perguntando: se tanto alhos como cebolas, parentes próximos em espécie e cheiro, têm sulfóxido de cisteína que é transformado pela alinase em ácido propenilsulfênico que vira espontaneamente tanto o cheiroso tiossulfinato quanto o ardido fator lacrimogêneo propanotial-S-óxido, por que diabos espremer alho não faz chorar? Ah… A resposta tradicional era que "por alguma razão, no alho cortado o ácido propenilsulfênico se transforma espontaneamente só no cheiroso tiossulfinato".
Ô desculpa fajuta!
Um grupo de japoneses acaba de publicar, na revista Nature de 17 de outubro, uma resposta muito melhor. A primeira parte da resposta é que o tal do ácido propenilsulfênico NÃO se transforma espontaneamente no fator lacrimogêneo coisíssima nenhuma.
A segunda parte é que quem faz isso é uma outra enzima, até então desconhecida, que apenas as cebolas possuem, e que os pesquisadores tiveram a original e conveniente idéia de nomear -- adivinhem! -- sintase do fator lacrimogêneo.
Ou seja: o ácido propenilsulfênico formado quando se destroem as células de alhos e cebolas se transforma espontaneamente, sim, no tiossulfinato que dá o perfume ao refogado. Mas os olhos só ardem com as cebolas porque só elas possuem a tal da segunda enzima que converte o mesmo ácido em fator lacrimogêneo.
O bacana é que isso quer dizer que dá, em princípio, para acabar com a produção do vilão fator lacrimogêneo sem mexer no tiossulfinato -- que é realmente o mocinho da estória: além de perfumado, é ele o responsável por todas as outras boas razões para se comer cebolas. O tiossulfinato é antiinflamatório, antialergênico, antiasmático, antidiabético, anti-hipertensivo...
E para acabar com a choradeira na cozinha, os pesquisadores sugerem nada menos que a criação de uma cebola transgênica sem a sintase do fator lacrimogêneo, que seria tão perfumada quanto as outras porque a alinase e a produção de tiossulfinato permaneceriam intocadas. Simples, não é?
Enquanto outros pesquisadores têm coisas mais importantes a fazer do que colocar cebolas-sem-sintase-do-fator-lacrimogêneo nos supermercados, a gente continua com os velhos truques para cortar cebolas sem chorar. Um truque (comprovado pelo Cérebro Nosso!) é colocar as cebolas na geladeira antes de cortar, já que o frio inibe a atividade das enzimas. Outros são cortar cebolas embaixo d'água (o que não é nada prático) ou na frente de um ventilador que sopre os vapores para longe de você; colocar óculos de mergulho e tapar o nariz com um pregador de roupa (senão o fator lacrimogêneo chega aos olhos pelo lado de dentro!); usar uma faca extremamente afiada, para diminuir a destruição das células… e tem até quem defenda um palito de fósforo preso nos lábios, ou um pedaço de pão na boca.
(Fonte: A Graça da Química)
domingo, 30 de janeiro de 2011
Trapaça Sexual
Esse assunto foi tratado em uma das palestras que tive na Semana da Química na UEM...
As abelhas que produzem mel polinizam as flores. Todos nós já vimos programas sobre a natureza e ouvimos dos narradores, cheios de autoridade, que "o instinto diz às abelhas que flores devem polinizar..." etc, etc. Instinto, coisa nenhuma. O sexo diz às abelhas que flores elas devem polinizar. As abelhas fêmeas da espécie Andrena nigroaenea produzem uma mistura complexa de pelo menos 14 alcanos e alcenos com 21 e 29 átomos de carbono. O odor dessa mistura atrai os zangões da espécie. Os atratores sexuais, ou feromônios, estão onipresentes no reino animal e são bastante específicos para cada espécie.[...] as coberturas protetoras das folhas que impedem a perda de agua são alcanos. A orquídea Ophrys sphegodes depende do zangão Andrena para a polinização. Curiosamente, a composição da cera das folhas da orquídea é quase idêntica à da mistura de feromônios da Andrena. Os três componentes principais do feromônio e da cera são os alcanos de cadeia linear tricosano (C23H48), pentacosano (C25H52) e heptacosano (C27H56), na relação 3:3:1.
Este é um exemplo do que é chamado de "imitação química", ou seja, o uso, por uma espécie, de uma substância química para obter uma determinada resposta, não necessariamente normal, de uma outra espécie. Esta orquídea é ainda mais inovativa do que a maioria das plantas, pois sua flor, cuja forma e cor se parecem com as do inseto, também produz a mistura semelhante o feromônio em alta concentração. Assim, o zangão não resiste, é atraído pela orquídea pelo que foi descrito pelos descobridores do feromônio como um caso de "trapaça sexual".
Fonte do texto: K.P.C. Volthard e N.E.Schore. Quimica Orgânica; estrutura e função. 4 ed.Trad.Ricardo Bicca de Alencastro et al. Porto Alegre, Bookman, 2004. p.92
Sorriso da Química =D
Sorria. Isso mesmo. Assim é bem melhor. Você concorda que o sorriso torna as pessoas mais bonitas, agradáveis e simpáticas? Observe. No mundo inteiro, qualquer que seja a cultura, no Oriente ou no Ocidente, o sorriso está sempre presente. Talvez, não haja gesto mais universal do que o sorriso. Ele aproxima as pessoas, "quebra o gelo", desanuvia ambientes. Pois saiba que a Química também contribui para que haja sorrisos mais bonitos e em maior número em todo o mundo.
Você está sorrindo por achar que é brincadeira? Pense bem. Sem a contribuição da Química, o homem não poderia contar com produtos como o creme dental e a escova de dentes. Esses acessórios da tão necessária higiene bucal são verdadeiros incentivadores do sorriso - afinal, sem eles, muitos sorrisos deixariam de existir ou seriam menos expressivos. Você já deu uma olhada na fórmula do seu dentifrício preferido? Pois verifique. Certamente você encontrará, entre outros, produtos químicos como sais de flúor, sorbitol, carbonato de cálcio, lauril sulfato de sódio, sacarina sódica e por aí vai. São produtos como esses que, em conjunto com a escova fabricada com plásticos de origem química, limpam e fortalecem dentes e gengivas, além de deixar o hálito mais agradável, garantindo a presença de sorrisos desinibidos e alegres.
Não pense, porém, que a participação da Química pára por aí. O fio dental, tão necessário para complementar a escovação, tem como base principal o náilon, um produto de origem química. Os purificadores de hálito têm em sua composição flúor, cloreto de cetilpiridínio, sorbitol e fluoreto de sódio, entre outros produtos químicos. Isso sem se falar nas embalagens desses produtos e, é claro, no verdadeiro arsenal desenvolvido pela Química para que os dentistas possam combater as cáries e restaurar dentes e sorrisos.
Bem, você pode argumentar que, antes da Química, o homem também sorria e fazia sua higiene bucal com outros materiais. É verdade. Mas também não se pode negar que, sem as descobertas da Química, o mundo teria menos sorrisos, até porque o acesso a produtos para a higiene bucal seria bem mais difícil, restringindo-se a poucos felizardos. Observe: sem a Química tudo ficaria muito mais difícil, inclusive conseguir um sorriso. Portanto, sorria
(Fonte: Abiquim)
quarta-feira, 19 de janeiro de 2011
Gás da voz do Pato Donald
Já ouviu falar no gás que distorce a voz, deixando ela mais fina? E sabe como isso acontece?
Para matar a charada é preciso recorrer a uma das mais importantes leis da física, aquela que diz que "quanto mais densa a molécula, menor sua velocidade".
O hélio, usado para encher balões, é sete vezes mais leve do que o ar que respiramos. Assim, quando ingerido, ele faz com que a velocidade com que a voz humana se propaga seja maior. Mas isso é apenas um pedaço da explicação.
A segunda parte da resposta está em outro ramo da física, a acústica. Quando aumentamos a velocidade do som, elevamos consequentemente a sua frequência (número de ondas sonoras formadas por segundo). Aumentando a freqüência, a voz tende a se tornar mais aguda e a soar bem estridente, como a voz do Pato Donald nos desenhos animados. "Do mesmo jeito, se um gás mais denso que o ar for ingerido, ele diminui a velocidade e a freqüência do som, e a voz engrossa, ou seja, se torna mais grave".
Fonte: Revista Superinteressante
Tema Sugerido por: Irmão.
terça-feira, 18 de janeiro de 2011
Existe líquido que não molha?
 |
| Mercúrio Líquido em contato com a pele: Moléculas não se desfazem. |
Mas se a força de coesão for maior do que a de adesão ocorrerá exatamente o contrário: a superfície não irá se molhar. É exatamente isso que acontece com o mercúrio que corre dentro dos termômetros, a atração entre as moléculas de mercúrio (coesão) não permite que se espalhem sobre determinadas superfícies, como a do vidro e das folhas de papel.
That's all, folks!
Por hoje é só, mas amanhã eu volto com mais algum tema...
Limão x Sol = Queimaduras?
Ia escrever sobre refrigeração hoje, mas, cheguei em casa com muita vontade beber limonada e enquanto cortava o limão lembrei de uma amiga que, certa vez, apareceu com queimaduras na pele depois de um churrasco... e você sabe por que isso acontece?
A exposição ao sol após o contato com o limão ou qualquer fruta ácida e algumas plantas, provoca manchas na pele. Tais manchas são causadas por uma manifestação alérgica denominada fitofotomelanose e ocorrem principalmente nas mãos, braço e boca (locais mais propensos ao contato).
As manchas são provocadas por causa do elemento chamado bergapteno, presente nas cascas, raízes e frutas verdes que é absorvido pela pele. Ao entrar no organismo, essa substância absorve grande quantidade de radiação solar que provoca inflamações na pele.
As manchas podem ter tamanho e coloração variada de acordo com a quantidade do suco em contato com a pele. Existem casos em que a quantidade do suco é tão grande que atinge a camada mais profunda da pele (a derme) e provoca manchas avermelhadas e bolhas.
Normalmente, as manchas provocadas por exposição de sucos ácidos e plantas com posterior exposição ao sol tendem a desaparecer com o passar dos tempos. Porém, se porventura as manchas não apresentarem nenhuma modificação quanto ao clareamento, é recomendável buscar orientação médica para a aplicação de pomadas que poderão auxiliar no tratamento. É importante a utilização de protetor solar na região afetada, para que a mancha não se torne permanente na pele.
Ao manusear frutas e sucos ácidos e ainda plantas, é imprescindível a lavagem das mãos e regiões próximas para evitar o aparecimento de tais manchas. Então, gente, cuidado com o limão em dias de sol, ok?!
(Fonte: www.mundoeducação.com.br)
As manchas são provocadas por causa do elemento chamado bergapteno, presente nas cascas, raízes e frutas verdes que é absorvido pela pele. Ao entrar no organismo, essa substância absorve grande quantidade de radiação solar que provoca inflamações na pele.
As manchas podem ter tamanho e coloração variada de acordo com a quantidade do suco em contato com a pele. Existem casos em que a quantidade do suco é tão grande que atinge a camada mais profunda da pele (a derme) e provoca manchas avermelhadas e bolhas.
Ao manusear frutas e sucos ácidos e ainda plantas, é imprescindível a lavagem das mãos e regiões próximas para evitar o aparecimento de tais manchas. Então, gente, cuidado com o limão em dias de sol, ok?!
(Fonte: www.mundoeducação.com.br)
segunda-feira, 17 de janeiro de 2011
Porque pegar a garrafa pelo meio congela a cerveja?
Bem, não que eu goste tanto assim de cerveja ou que esse blog pertença a uma botequeira,rs .... Mas digamos que a cerveja é um tema "frequente" quando falamos de química no dia-a-dia... Então, quando você estiver no bar com os amigos tomando aquela gelada...explique porque não se deve pegar a garrafa pelo meio, afinal, cerveja também é cultura.
Boteco, baixa gastronomia, bate-papo e loiras geladas. Extremamente geladas, por sinal. O garçom traz a garrafa, você vai servir no copo do pessoal e tudo o que sai dela é uma espécie de raspadinha de cerveja. O fenômeno possui, porém, um nome científico: superfusão.
A cerveja (Tão querida!), nada mais é do que uma solução aquosa. Na água nós temos as substâncias responsáveis pelo sabor e odor dissolvidas, juntamente com o álcool e o gás carbônico. Ao ser engarrafada, a pressão interna aumenta, abaixando o ponto de congelamento. A presença do álcool também abaixa o ponto de congelamento, mas por estar presente em pequena quantidade (aproximadamente 5% na cerveja), altera pouco. A mistura de todas estas substâncias é que explica porque a cerveja não congela em temperatura bem abaixo da de congelamento da água, sendo possível encontrá-la no estado líquido mesmo abaixo de 0 ºC.
A sobrefusão ocorre porque a cerveja recebe em sua fabricação a adição de gás carbônico (CO2), que aumenta a pressão dentro da garrafa. A pressão e as baixas temperaturas fazem com que uma quantidade maior de gás carbônico permaneça no líquido. Em certas temperaturas pouco abaixo de zero graus Celsius, essa mistura encontra-se em estado bastante instável (em sobrefusão), em que uma pequena alteração na temperatura basta para congelá-la.
Quando seguramos a garrafa pelo meio, causamos um desequilíbrio em seu interior, O calor de nossas mãos faz com que mais gás carbônico dissolvido na cerveja passe do estado líquido para o estado gasoso, sendo liberado. Isso reduz ainda mais a temperatura do líquido, que acaba congelando. Quando, porém, seguramos a garrafa pelo gargalo, a alteração é mínima e a cerveja permanece líquida.
Boteco, baixa gastronomia, bate-papo e loiras geladas. Extremamente geladas, por sinal. O garçom traz a garrafa, você vai servir no copo do pessoal e tudo o que sai dela é uma espécie de raspadinha de cerveja. O fenômeno possui, porém, um nome científico: superfusão.
A cerveja (Tão querida!), nada mais é do que uma solução aquosa. Na água nós temos as substâncias responsáveis pelo sabor e odor dissolvidas, juntamente com o álcool e o gás carbônico. Ao ser engarrafada, a pressão interna aumenta, abaixando o ponto de congelamento. A presença do álcool também abaixa o ponto de congelamento, mas por estar presente em pequena quantidade (aproximadamente 5% na cerveja), altera pouco. A mistura de todas estas substâncias é que explica porque a cerveja não congela em temperatura bem abaixo da de congelamento da água, sendo possível encontrá-la no estado líquido mesmo abaixo de 0 ºC.
A sobrefusão ocorre porque a cerveja recebe em sua fabricação a adição de gás carbônico (CO2), que aumenta a pressão dentro da garrafa. A pressão e as baixas temperaturas fazem com que uma quantidade maior de gás carbônico permaneça no líquido. Em certas temperaturas pouco abaixo de zero graus Celsius, essa mistura encontra-se em estado bastante instável (em sobrefusão), em que uma pequena alteração na temperatura basta para congelá-la.
Quando seguramos a garrafa pelo meio, causamos um desequilíbrio em seu interior, O calor de nossas mãos faz com que mais gás carbônico dissolvido na cerveja passe do estado líquido para o estado gasoso, sendo liberado. Isso reduz ainda mais a temperatura do líquido, que acaba congelando. Quando, porém, seguramos a garrafa pelo gargalo, a alteração é mínima e a cerveja permanece líquida.
domingo, 16 de janeiro de 2011
Coca-Cola e Mentos
Por Que a Mistura de Coca Light e Mentos Provoca uma Explosão?
As balas de Mentos provocam uma pequena revolução na garrafa: em contato com o refrigerante, as balas aumentam a quantidade de gás e provocam o surgimento de bolhas grandes, que tendem a escapar na forma de um jato explosivo. O equilíbrio entre o gás e o líquido nos refrigerantes é facilmente quebrável. "Se você pegar um pedaço de gelo e jogar na Coca, também vão se formar bolhas em torno dele. Qualquer coisa que quebre a homogeneidade do sistema gás-líquido provoca uma saída de gás (CO2)". O ácido carbônico (H2CO3) presente no refrigerante é instável e rapidamente se decompõe: H2CO3 → CO2(g) + H2O
O Mentos desloca o equilíbrio na direção da formação do gás carbônico, que preso na garrafa aumenta a pressão, causando a explosão. Mas por que só com o Mentos ocorre a explosão? Mais densa que o refrigerante, a bala vai direto para o fundo da garrafa quando jogada lá dentro. Além disso, o Mentos tem ácido cítrico - o mesmo do limão -, que tende a aumentar a formação de gás carbônico. Outro fator é a superfície irregular da bala - vista pelo microscópio, ela apresenta buracos minúsculos. E, quanto mais irregular uma superfície, maior a tendência de provocar bolhas. E a Coca Light, apesar de ter se consagrado na internet como o refrigerante ideal para essa bomba, não é a única bebida que provoca o jato. Experiências com guaraná e soda também deram certo.
Na teoria, isso pode acontecer com qualquer refrigerante, especialmente nos diet e light. Por ser mais denso por causa do açúcar, o refrigerante normal retém a expansão do gás carbônico. No refrigerante diet, que não leva açúcar na fórmula, as bolhas têm mais liberdade para se movimentar.
Na teoria, isso pode acontecer com qualquer refrigerante, especialmente nos diet e light. Por ser mais denso por causa do açúcar, o refrigerante normal retém a expansão do gás carbônico. No refrigerante diet, que não leva açúcar na fórmula, as bolhas têm mais liberdade para se movimentar.
Porque colocando sal no gelo a cerveja gela mais rápido?
O sal altera as temperaturas em que a água muda de estado físico. No caso do gelo da cerveja, adição de sal faz com que a água necessite de mais energia para passar do estado sólido para o líquido, perdendo mais calor. O resultado é uma cerveja mais gelada do que outra que estivesse mergulhada em gelo puro. O sal é usado porque está sempre à mão em uma mesa. Mas pode ser substituído por qualquer outro pó solúvel em água, como o açúcar, por exemplo. O mesmo fenômeno ocorre quando se põe água salgada para ferver. Neste caso a água também vai necessitar mais calor para deixar de ser um líquido e passar a ser um gás. Entretanto, neste caso, o calor extra é puxado da chama do fogo e a temperatura de ebulição se eleva.
Apresentações
“Viver é como andar de bicicleta: É preciso estar em constante movimento para manter o equilíbrio.”
Albert Einstein
Já faz um certo tempo que penso em criar um blog sobre acontecimentos do dia-a-dia que me remetem a questões científicas ... Como estudante de química, as vezes, durante o dia, me pego pensando sobre o porquê de certas coisas que antes me eram indiferentes. Coisas rotineiras, que estão ao nosso redor e acontecem o tempo todo...mas que nem sempre nos preocupamos em entender como e porque elas acontecem.
Como ainda sou uma estudante do curso de graduação em química e a cada dia aprendo um pouco mais...espero que este blog demonstre isso e esteja também cada dia melhor.
E essa antiga ideia me voltou quando na virada no ano, em um churrasco, me perguntaram porque a cerveja gela mais rápido quando coloca-se sal no gelo ...
Here we go...
(Imagem: Capa do livro de Len Fisher "A Ciência no Cotidiano" - grande inspirador do blog)
Assinar:
Postagens (Atom)

















